MDR認証(EUの医療機器規則に基づく医療機器認証審査)
医療機器の法的製造者は、MDR(Medical Device Regulation(EU)2017/745:医療機器のCEマーキング)でClass lll、Class llb、Class llaもしくはClass l(滅菌医療機器、計測機能を有する医療機器または再使用可能な外科用器具)にクラス分類されている医療機器をEU市場へ流通させる前に、Notified BodyからMDRに基づく認証を取得する必要があります。SGSはNotified Body(CE0598、CE1639)として指定されており、さまざまな医療機器に対するMDRの認証審査サービスを提供しています。
SGSからCertificateが発行された後、該当機器にCEマークを貼付して流通を開始することが可能となります。
SGSを選ぶメリット
SGSのグローバルネットワークを活用することで、幅広い医療機器に対する認証審査が可能です。
SGSジャパンがお客様の担当窓口となり、MDRの認証に向けてサポートします。
また原則として、経験豊富な日本人の審査員が品質マネジメントシステム審査を実施します。
MDRの認証審査と併せて、薬機法におけるQMS関連審査、ISO13485、MDSAP、UK MDR 2002、ISO9001との複合審査も可能です。
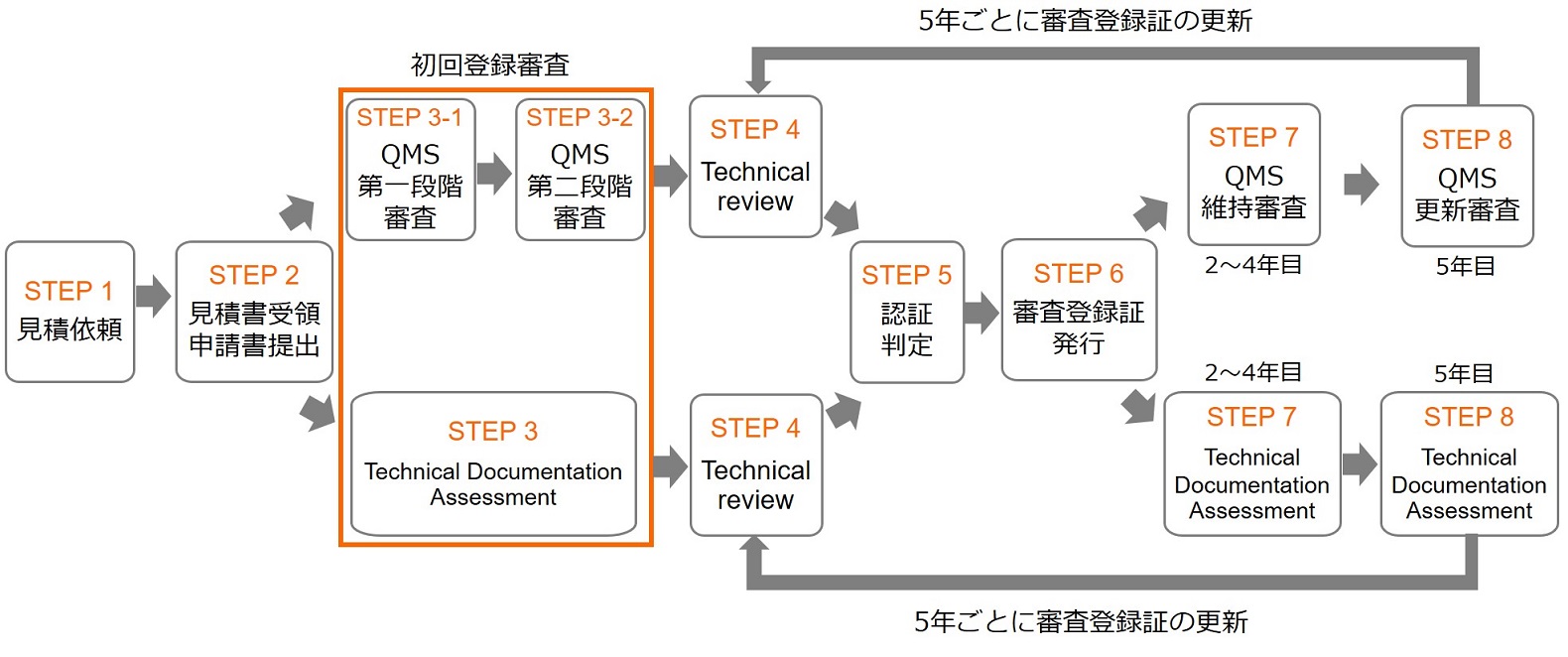
MDRの認証プロセス
MDR認証取得の注意事項
- MDR Article 2に基づき、対象となる製品が、EUにおける医療機器に該当するか確認してください。
- EUにおける医療機器である場合、MDR Annex Vlllを確認し、適用されるクラス分類を決定してください。
- 適用する適合性評価ルートを決定してください。
- MDRやMDCG等を確認し、Technical documentationおよびQMSを構築してください。
GSPRへの適合性を立証するために試験や評価を実施する場合、European harmonized standardを基準としてください。
参考情報(外部リンク)
関連ページ
お問い合わせ
SGSジャパン株式会社
ビジネス アシュアランス
医療機器認証部
TEL:050-1780-7872


 (144KB)
(144KB)