ISO13485認証
ISO13485は医療機器・体外診断用医薬品を取り扱う組織に適用されることを意図した品質マネジメントシステム規格です。医療機器を取り扱う組織の品質システムが規制要求事項に適合していることを証明するために活用されています。
薬機法における省令169号がISO13485を参考として構築されたものであることはよく知られていますが、他国へ医療機器・体外診断用医薬品を輸出する際の規制要求事項や取引条件として活用されるケースも少なくありません。
SGSを選ぶメリット
SGSは、ISO13485制定時から認証機関として活動しています。
日本国内でも数百社を超える組織を認証しており、信頼性の高い認証機関としての評価を受けています。
また、ISO13485の認証審査と併せて、薬機法におけるQMS適合性調査、Regulation(EU)2017/745(MDR)(医療機器のCEマーキング)、UK MDR 2002(イギリスの規制に基づく医療機器認証)、MDSAP、ISO9001との複合審査も可能です。
ISO13485の認証プロセス
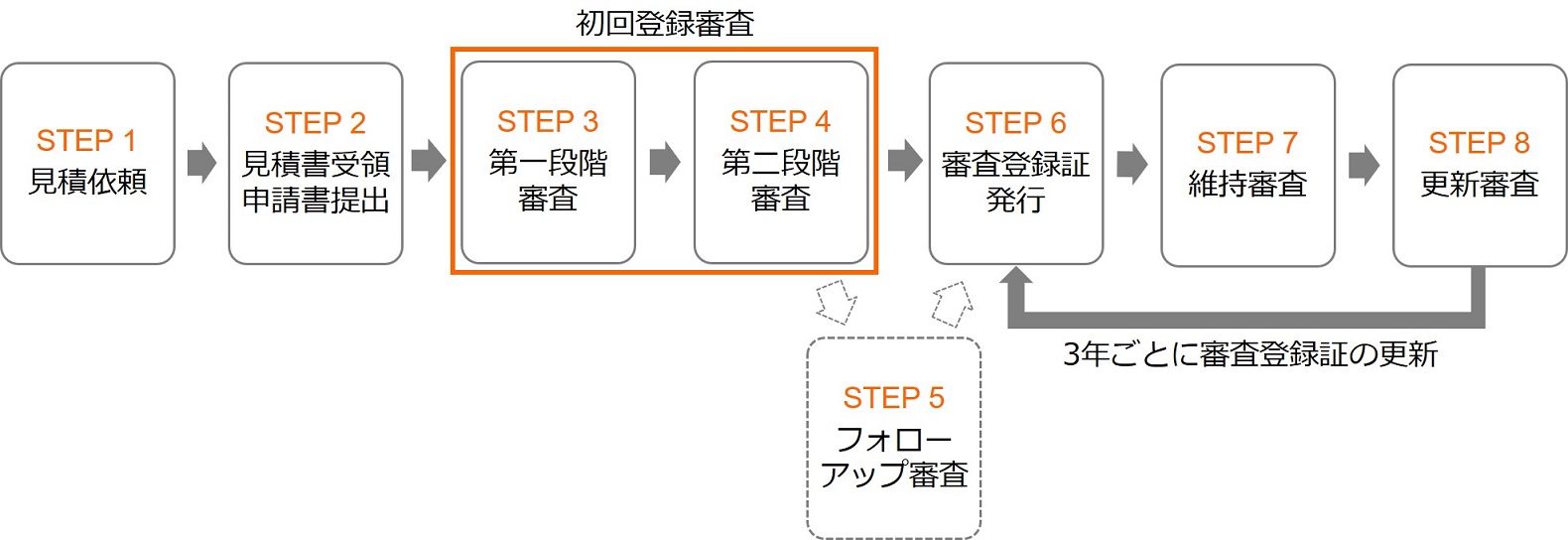
| STEP 1 | 見積り依頼 |
| ▼ | 見積依頼書をご提出いただきます。 |
| STEP 2 | 見積書の受領・申請書のご提出 |
| ▼ | 正式なご契約となります。 |
| STEP 3 | 第一段階審査 |
| ▼ | 規格要求事項に適合したマニュアル、手順類(文書)の策定状況を確認します。 |
| STEP 4 | 第二段階審査 |
| ▼ | 文書に基づいたシステムの導入・運用状況を確認します。 |
| STEP 5 | フォローアップ審査 |
| ▼ | 重大な不適合が指摘された場合は、フォローアップ審査を実施します。 ※維持審査、更新審査の場合も発生する可能性があります。 |
| STEP 6 | 審査登録証の発行 |
| ▼ | 認証の推薦から審査登録証発行までは、約1~2ヵ月。 |
| STEP 7 | 維持審査 |
| ▼ | 1回/年または2回/年をご選択ください。 |
| STEP 8 | 更新審査 |
| 3年ごとに更新審査を実施し、審査登録証を更新します。 |
ISO13485見積依頼書
 (102KB)
(102KB)
ISO13485認証取得の注意事項
- ISO13485の認証の対象とする製品及び活動を決定します。その際、認証対象となる製品が、医療機器(体外診断用医療機器含む)、医療機器アクセサリー、医療機器用の部品・材料などに該当するか確認します。
- 組織が医療機器を輸出している場合、日本では医療機器でなくても、輸出先国で医療機器に該当する場合もあります。
- 認証登録対象事業所を決定する際、規格要求事項に該当する活動をしている部署は除外できません。ご注意ください。
- ISO13485の規格要求事項に従った品質マネジメントシステムを構築し、維持、運用することになります。規制要求事項はISO13485の要求事項となりますので、該当医療機器を流通している国の規制(日本であれば薬機法、輸出している場合は輸出先国の医療機器規制)に対応したシステムの構築をお願いします。
お客様の声
- 医療機器業界において、国内外の法規制要求のQMSとISO13485の規格要求が整合化されていることが多く、ISO13485の認証が取引の条件となっている。SGSの場合、ISO13485の審査だけでなく、薬機法やMDRの審査など複数同時に実施でき、国際的な認証の信用度も高いのでありがたい。
- 医療機器のリスクとプロセスの複雑さに応じたメリハリのある審査をしていただいています。経験の浅い従業員にも丁寧に接していただいていますので助かっています。
- ISO9001を取得しているのですが、今回初めてSGSのISO13485の審査を受けました。審査チームの方々が医療機器に精通されていることに大変驚かされました。滅菌バリデーションの指摘は勉強になりました。
- 営業の方が良く勉強されています。事務所のスタッフも丁寧に対応してくれているので、好感がもてます。
ISO13485関連セミナー
関連サービス
お問い合わせ
SGSジャパン株式会社
ビジネス アシュアランス
医療機器認証部
TEL:050-1780-7872
