医薬品医療機器等法基準適合性認証
2005年4月の改正薬事法により、第三者認証制度が開始されました。
製造販売業者が指定(高度)管理医療機器/体外診断用医薬品を取り扱う場合には、厚生労働省に登録された登録認証機関への製造販売認証申請が必要となります。
製造販売認証申請時に、以下の審査が実施されます。
- 基準適合性評価(認証申請書及び添付資料のレビュー審査)
- 製造販売業者および製造所ごとのQMS適合性調査
これらの審査が終了した後、認証判定のプロセスを経て、申請品目に対する認証番号が発行されます。
SGSを選ぶメリット
SGSジャパンは、2005年4月1日付けで、厚生労働省に登録認証機関として登録されて以来、数多くの認証審査を実施しています。
CEマーキングやISO13485、MDSAPを含む医療機器関連審査での経験・実績をもつ審査チームが、本審査サービスを担当します。
また、いち早い認証をご希望のお客様には、オプションサービスも用意しています。
能動医療機器の承認・認証申請に関わる製品安全試験やEMC試験など各種試験サービスや規格解釈の研修サービスも提供していますので、ワンストップでのサービスのご案内が可能です。
認証申請を検討されている製造販売業者様は、ぜひお問い合わせください。
SGSジャパンにて認証可能な範囲
|
|
など認証いたします。
詳細は、「認証区分」をご覧ください。
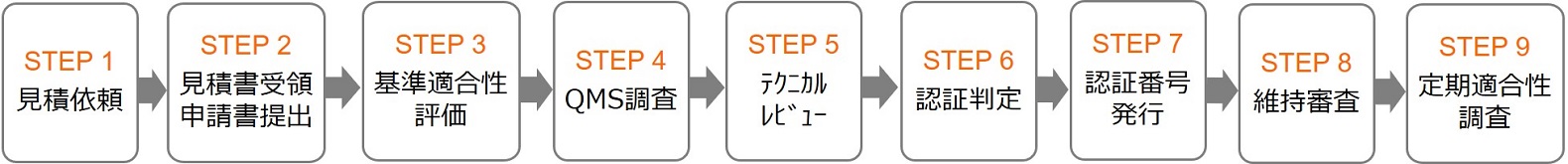
医薬品医療機器等法基準適合性認証の認証プロセス
| STEP 1 | 見積り依頼 |
| ▼ | 見積依頼書をご提出いただきます。 |
| STEP 2 | 見積書の受領・申請書のご提出 |
| ▼ | 正式なご契約となります。 |
| STEP 3 | 基準適合性評価 |
| ▼ | 認証申請書および添付資料のレビュー審査 |
| STEP 4 | QMS調査 |
| ▼ | 製造販売業者およびQMS適合性調査申請書の製造方法欄に記載されている 製造所すべてに対してQMS適合性調査を実施します。 |
| STEP 5 | テクニカルレビュー |
| ▼ | |
| STEP 6 | 認証の判定 |
| ▼ | |
| STEP 7 | 認証番号の発行 |
| ▼ | |
| STEP 8 | 維持審査 |
| ▼ | 1回/年 |
| STEP 9 | 定期適合性調査 |
見積依頼書_医療機器共通書式(新規/一部変更/定期など)
 (171KB)
(171KB)
医薬品医療機器等法基準適合性認証取得の注意事項
認証申請前の確認事項
医療機器の場合
- 申請される機器が1品目の範囲内であること
- 申請される機器が一般的名称の定義の範囲内であること
- 認証基準および基本要件基準に適合していること
- 申請される機器が告示112号のただし書きに抵触しないこと、申請される機器の製造所が厚生労働大臣の登録を受けていること、あるいは見なされていること
体外診断用医薬品の場合
- 申請される品目が1品目の範囲内であること
- 申請される品目が一般的名称の定義の範囲内であること
- 申請される品目が認証基準に適合すること 申請される品目の製造所が厚生労働大臣の登録を受けていること、あるいは見なされていること
よくあるご質問
Q. 申請内諾前提の仮押さえサービスは、申請予定のどの程度前から可能ですか?
A. いつでも可能ですが、本サービスはSGSに認証申請を決定されたお客様のみにご提供するサービスです。見積依頼書をご提出いただく段階もしくはそれ以降に認証申請書提出時期をお知らせください。審査日程の事前確保が可能です。早めに審査日程を確保しつつ、申請書類のご準備を並行して進められると効率的です。
Q. 初めて認証申請をします。何を準備して良いか分からないため教えてください。
A. 申し訳ございません。弊社含め登録認証機関は公平性の観点よりご申請組織様固有の助言は禁止されております。関連法規制の規格解釈などは一般的な教育研修サービスとして提供していますので、ご利用をご検討ください。
省令・通知類
指定(高度)管理医療機器および体外診断用医薬品の認証申請に関連する通知などは、「省令・通知類」をご参照ください。
承認申請に関する通知でも、認証業務の参考となるものも掲載しています。
サービスに関する基本情報
情報の公開
関連サービス
お問い合わせ
SGSジャパン株式会社
ビジネス アシュアランス
医療機器認証部
TEL:050-1780-7872

 (424KB)
(424KB)