UK MDR 2002認証(イギリスの規制に基づく医療機器認証(UKCA))
医療機器の法的製造業者は、イギリスの医療機器規制UK Medical Devices Regulations 2002(UK MDR 2002)でClass lll, Class llb, Class llaもしくはClass l(滅菌医療機器または計測機能を有する医療機器)にクラス分類されている医療機器、List A, List B, Self-testingに分類される体外診断用医療機器をGreat Britain(イングランド、ウェールズ、スコットランド)に流通させる前に、イギリスの規制当局であるMHRAより承認されたApproved bodyからUK MDR 2002に基づく認証を取得する必要があります。
SGSはApproved Body(AB0120)として、さまざまな医療機器(体外診断用医療機器含む)に対するUK MDR 2002の認証審査サービスを提供しています。
SGSからCertificateが発行された後、該当機器にUKCAマークを貼付して流通を開始することが可能となります。
なお2023年6月30日までは、MDRないしはMDDにおいて、EUのNotified Bodyにより認証されている医療機器をGreat Britainに流通させることが可能ですが、2023年7月1日以降は、UK MDR 2002に基づき認証された機器の流通が必須化されます。
SGSを選ぶメリット
SGSのグローバルネットワークを活用することで、幅広い医療機器に対する認証審査が可能です。
SGSジャパンがお客様の担当窓口となり、UK MDR 2002の認証に向けてサポートします。
また原則として、経験豊富な日本人の審査員が品質マネジメントシステム審査を実施します。
UK MDR 2002の認証審査と併せて、薬機法におけるQMS関連審査、ISO13485、MDSAP、MDR、ISO9001との複合審査も可能です。
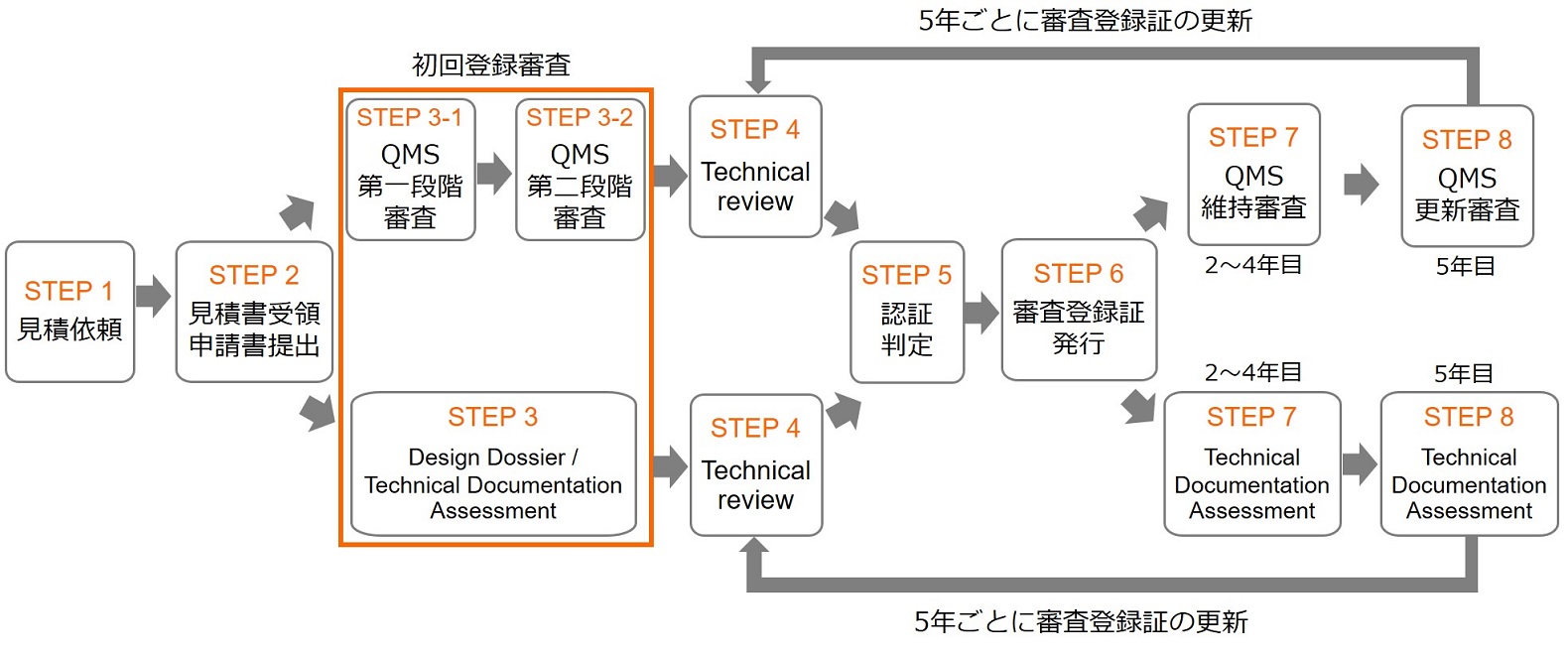
UK MDR 2002の認証プロセス

UKCA認証取得の注意事項
- UK MDR 2002 Part 1に基づき、対象となる製品が、Great Britainにおける医療機器に該当するか確認してください。
- Great Britainにおける医療機器である場合、UK MDR 2002 Reg7を確認し、適用されるクラス分類を決定してください。
- 適用する適合性評価ルートを決定してください。
- Technical documentationおよびQMSを構築してください。UK MDR 2002はMDDおよびIVDDを参照していますので、これらを参考にご準備ください。
参考情報(外部リンク)
関連ページ
お問い合わせ
SGSジャパン株式会社
ビジネス アシュアランス
医療機器認証部
TEL:050-1780-7872
